Настоящая инструкция предназначена для микробиологического контроля виноматериалов, купажей, чистой культуры дрожжей, ликеров, полуфабрикатов, готовой продукции, вспомогательных материалов, а также для контроля за соблюдением технологических и санитарно-гигиенических режимов в производстве шампанского и игристых вин.
Систематическое проведение микробиологического контроля позволяет следить за нормальным развитием чистых культур дрожжей и своевременно обнаруживать присутствие посторонней микрофлоры.
Инструкция является руководящим документом для работников заводских лабораторий при микробиологическом контроле производства шампанского и игристых вин.
Выполнение микробиологического контроля поручается лаборатории завода, которая несет ответственность за результаты анализов и внесение их в журналы ТХМК (Приложение 2).
1. Схема и общие правила контроля технологического процесса
1.1. Контроль поступающих виноматериалов
1.1.1. Пробы из поступающих виноматериалов отбирают по ГОСТ 14137-74 «Вино, виноматериалы, коньяки и коньячные спирты. Правила приемки и методы отбора проб», подвергают органолептической оценке и микроскопируют.
Виноматериал, содержащий в поле зрения не более 2 клеток бактерий при отсутствии спор плесневых грибов и клеток диких дрожжей, оценивается на «хорошо»; не более 3 клеток диких дрожжей или 5 клеток бактерий при отсутствии спор плесневых грибов — «удовлетворительно»; свыше 3 клеток диких дрожжей или 5 клеток бактерий — «неудовлетворительно». Виноматериал с оценкой «удовлетворительно» следует подвергать фильтрации и сульфитации; с оценкой «неудовлетворительно» — фильтрации, пастеризации при температуре 80 °С, фильтрации и сульфитации.
1.1.2. Для установления микробиологической чистоты виноматериалов и определения видового состава обнаруженных микроорганизмов в случае необходимости проводят посев на твердые и жидкие среды (Приложения 2, 4).
1.1.3. Вино, в котором проходит биологическое кислотопонижение, подвергают микробиологическому и химическому контролю не реже 1 раза в 10 дней. О начале яблочно-молочного брожения свидетельствуют резкое увеличение количества бактерий, снижение массовой концентрации титруемых кислот, повышение массовой концентрации летучих кислот. Завершается этот процесс в течение 15 — 20 сут. О его окончании судят по уменьшению пятен яблочной кислоты на хроматограмме. После окончания яблочно-молочного брожения вино фильтруют, сульфитируют из расчета массовой концентрации общей сернистой кислоты в вине от 100 до 120 мг/куб. дм и подвергают оклейке.
1.2. Контроль обработки и выдержки виноматериалов и купажей
1.2.1. Технологический процесс обработки ассамбляжей и купажей подвергают микробиологическому контролю.
В препаратах обработанного ассамбляжа и купажа после центрифугирования допускается не более 2 клеток мертвых микроорганизмов; при наличии большего числа микроорганизмов необходима повторная фильтрация или перезарядка фильтра.
1.2.2. Ассамбляжи и купажи, находящиеся на выдержке, микроскопируют после центрифугирования не реже 1 раза в месяц. При содержании в поле зрения не более 2 клеток мертвых микроорганизмов они оцениваются на «хорошо», не более 5 — «удовлетворительно». При развитии в ассамбляжах и купажах микроорганизмов они считаются неудовлетворительными и не подлежат дальнейшему хранению. Вино подвергают сульфитации, оклейке и фильтрации.
1.2.3. Для доливки резервуаров используют микробиологически чистое вино не моложе доливаемого.
1.2.4. Готовый купаж микроскопируют и испытывают на микробную стойкость. Купаж не должен содержать жизнеспособных микроорганизмов.
1.3. Контроль обескислороживания купажей
1.3.1. Купаж с дрожжевой разводкой, подаваемый на обескислороживание, контролируют не реже 1 раза в неделю. Смесь должна содержать 2 — 3 млн. клеток/куб. см дрожжей в хорошем физиологическом состоянии, доля мертвых дрожжей не должна быть более 5%, инфицированность бактериями и дикими дрожжами не допускается.
1.3.2. Обескислороженный купаж микроскопируют после центрифугирования 1 раз в неделю. Купаж, содержащий в поле зрения не более 3 клеток мертвых дрожжей или единичные молочнокислые бактерии, оценивается на «хорошо»; не более 6 мертвых клеток дрожжей или не более 5 клеток бактерий — «удовлетворительно»; единичные клетки диких дрожжей или более 5 клеток молочнокислых бактерий — «неудовлетворительно».
При хорошей и удовлетворительной оценке обескислороженный купаж контролируют 1 раз в неделю, а при неудовлетворительной оценке проводят санитарную обработку и перезарядку ферментера.
1.4. Контроль приготовления чистой культуры дрожжей
1.4.1. На всех стадиях приготовления разводки чистой культуры дрожжей обязательны строгое соблюдение правил санитарии и микробиологический контроль.
1.4.2. Раса дрожжей, применяемая в производстве, должна проверяться Отраслевой лабораторией технологии игристых вин Всероссийского научно-исследовательского института пивоваренной, безалкогольной и винодельческой промышленности 1 раз в год.
1.4.3. Для приготовления производственной разводки дрожжей используют последнюю генерацию дрожжей, в которой доля физиологически активных клеток составляет 95%, приготовленную в заводской лаборатории. Начальная концентрация дрожжей при загрузке дрожжерастильных аппаратов должна составлять не менее 10 млн. клеток/куб. см.
1.4.4. Питательную среду подвергают пастеризации и фильтрации. Питательная среда для приготовления разводки чистой культуры дрожжей не должна содержать микроорганизмы.
1.4.5. Дрожжевую разводку из всех дрожжерастильных аппаратов контролируют ежедневно, определяя количество клеток дрожжей и их физиологическое состояние (долю почкующихся и мертвых клеток, %).
1.4.6. Каждую дрожжевую разводку, отпускаемую производству, контролируют. Дрожжевая разводка с концентрацией не ниже 60 млн. клеток/куб. см, в которой доля мертвых клеток составляет не более 5%, оценивается на «хорошо»; с концентрацией дрожжей не менее 30 млн. клеток/куб. см с долей мертвых клеток не более 8% — «удовлетворительно»; с концентрацией дрожжей ниже 30 млн. клеток/куб. см с долей мертвых клеток больше 10% — «неудовлетворительно». Наличие в дрожжевой разводке посторонней микрофлоры не допускается, дрожжерастильный аппарат перезаряжают, предварительно подвергнув его санитарной обработке.
1.4.7. Воздух, поступающий от воздуходувки через обеспложивающий фильтр, контролируют 2 раза в месяц методом посева на твердую питательную среду. При росте более 5 колоний микроорганизмов обеспложивающий фильтр перезаряжают.
1.5. Контроль процесса шампанизации
Бутылочный способ
1.5.1. Содержание клеток дрожжей, физиологическое состояние и равномерность их распределения в тиражной смеси определяют непосредственно перед розливом. Концентрация дрожжей в тиражной смеси должна составлять 1 млн. клеток/куб. см с долей жизнеспособных клеток 95%; наличие посторонних микроорганизмов не допускается.
1.5.2. Процесс вторичного брожения каждой однородной партии тиража (по бутам) контролируют не менее 3 раз до окончания брожения, т.е. 1 раз в 10 сут. Содержание и физиологическое состояние дрожжевых клеток учитывают прямым микроскопированием шампанизируемого вина из бутылки.
1.5.3. При перекладках кюве в процессе послетиражной выдержки микробиологический контроль предусматривает наблюдение за изменением структуры осадка, его однородности в верхних и нижних бутылках уложенного штабеля, за физиологическим состоянием дрожжей и наличием посторонней микрофлоры в осадках.
1.5.4. При отклонении от нормального течения ремюажа микробиолог проверяет качество осадков и устанавливает причины.
1.5.5. Качество фильтрации экспедиционного ликера проверяют перед дозированием в бутылки.
1.5.6. Шампанское, используемое для дозировки, подвергают микробиологическому контролю.
1.5.7. Готовую продукцию подвергают микробиологическому контролю путем прямого микроскопирования центрифугированной пробы и посева вина на агаризованную питательную среду, а также испытанию на микробную стойкость вина (Приложение 4). В отдельных бутылках с шампанским (не более 2 из 10 бутылок) допускается наличие не более 2 мертвых клеток микроорганизмов и белковых частиц.
Непрерывный способ
1.5.8. Купаж после термообработки, направляемый на приготовление бродильной смеси, контролируют не реже 1 раза в месяц. При наличии диких дрожжей и бактерий в препарате купажа (после центрифугирования) необходимо провести санитарную обработку и перезарядку оборудования.
1.5.9. Качество фильтрации смеси купажа с ликером проверяют 1 раз в неделю.
1.5.10. Смесь купажа с ликером из передаточного резервуара контролируют 2 раза в месяц. При обнаружении микроорганизмов проводят санитарную обработку и перезарядку оборудования.
1.5.11. Бродильную смесь перед входом в аппараты для шампанизации контролируют не реже 1 раза в неделю. Она не должна содержать посторонних микроорганизмов, концентрация дрожжей должна составлять от 3 до 5 млн. клеток/куб. см с долей жизнеспособных клеток 95%.
1.5.12. Процесс шампанизации вина контролируют не реже 1 раза в 20 сут. В шампанизируемом вине определяют количество дрожжевых клеток, долю почкующихся и мертвых клеток; не допускается присутствие жизнеспособной инфицирующей микрофлоры.
1.5.13. Шампанизированное вино на выходе из установок микроскопируют 1 раз в неделю. Оно не должно содержать живых клеток дрожжей и посторонней микрофлоры.
1.5.14. Охлажденное шампанизированное вино из аппарата для обработки холодом контролируют 2 раза в год. При наличии в препарате посторонних микроорганизмов аппарат следует перезарядить.
1.5.15. Шампанское в приемных аппаратах перед розливом контролируют, в нем не должно быть микроорганизмов.
Резервуарный периодический способ
1.5.16. Бродильную смесь из акратофора после перемешивания подвергают контролю. Концентрация дрожжей должна быть от 2 до 4 млн. клеток/куб. см с долей жизнеспособных 95%. Бродильная смесь не должна содержать посторонних микроорганизмов.
1.5.17. Допускается загрузка на дрожжи, оставляемые в акратофоре от предыдущей загрузки, в случае положительного заключения микробиолога об их качестве и чистоте.
1.5.18. Процесс вторичного брожения контролируют не менее 2 раз до окончания брожения. В шампанизируемом вине определяют концентрацию дрожжевых клеток, долю почкующихся и мертвых клеток; не допускается присутствие посторонней микрофлоры.
1.6. Контроль розлива шампанского в бутылки и экспедиции
1.6.1. Качество мойки бутылок, приготовленных под налив, контролируют путем наружного осмотра и микроскопирования смывов ежедневно.
1.6.2. Пробки отбирают для микробиологического контроля ежедневно. Смывы с пробок не должны иметь постороннего запаха, механических частиц и микроорганизмов.
1.6.3. Проверяют качество фильтрации каждой партии шампанского.
1.6.4. Перед поступлением готовой продукции на внешнее оформление ее подвергают микробиологическому контролю путем прямого микроскопирования центрифугированной пробы, а также испытанию на микробную стойкость.
1.7. Контроль вспомогательных материалов
Объектами микробиологического контроля являются вода, оклеивающие вещества, танин, сахароза, лимонная кислота, двуокись углерода газообразная и др., так как они могут быть источниками инфекции.
1.7.1. Поступающую на завод воду микробиолог отбирает 1 раз в месяц. Анализ воды проводит санитарно-эпидемиологическая служба.
1.7.2. Каждую партию оклеивающих веществ, танина и лимонной кислоты проверяют при поступлении в производство. Они не должны содержать микроорганизмов, способных развиваться в вине, и механических включений.
1.7.3. Каждую партию сахарозы проверяют на присутствие спор плесневых грибов, слизеобразующих бактерий (Leuconostoc), микроорганизмов, способных развиваться в вине, а также механических включений (Приложение 8).
1.7.4. Контроль чистоты воздуха производственных помещений и углекислого газа проводят 1 раз в месяц.
1.8. Контроль санитарного состояния помещений, технологического оборудования и резервуаров
1.8.1. Производственные помещения контролируют один раз в неделю по внешним признакам путем осмотра поверхности резервуаров, стен, потолков, полов. При входе в производственные цеха на полу должны быть влажные коврики. Для предупреждения появления плесени ежегодно проводят побелку стен и потолка помещений раствором извести с добавлением медного купороса до массовой доли 10%.
1.8.2. Для предотвращения появления уксусной мушки (дрозофилы) в производственных помещениях при доливках, фильтрации, розливе и пр. следует тщательно обрабатывать наружные поверхности оборудования, фильтры, полы слабым раствором сернистого ангидрида.
1.8.3. Контроль обработки оборудования включает:
• внешний осмотр с целью выявления механических загрязнений, осадков, посторонних запахов;
• сравнение прозрачности и окраски последней смывной воды с водопроводной;
• микроскопирование смывов или мазка с поверхности оборудования.
При обнаружении жизнедеятельных микроорганизмов мойку и обработку оборудования следует повторить.
1.8.4. Резервуары после освобождения необходимо немедленно мыть, обрабатывать дезинфицирующими растворами, остатки воды удалять и контролировать качество обработки. Если резервуар был проверен, но не залит в течение нескольких дней, то контроль перед загрузкой повторяют.
1.8.5. Фильтры проверяют после обработки и мойки путем внешнего осмотра разобранного фильтра и микроскопирования смывов и мазков.
1.8.6. Насосы, шланги и коммуникации контролируют после обработки и промывки не реже 1 раза в неделю путем осмотра и микроскопирования последней смывной воды. После окончания работы насосов, шлангов и коммуникаций их необходимо мыть и контролировать качество обработки перед использованием.
1.8.7. Разливочные автоматы проверяют перед началом работы разливочной линии путем внешнего осмотра и микроскопирования смывных вод и мазков с нескольких участков.
2. Описание методов контроля
2.1. Отбор и подготовка проб к анализу
Все пробы, предназначенные для микробиологического исследования, следует отбирать при строгом соблюдении стерильности, чтобы исключить возможность загрязнения извне.
Перед отбором пробы следует тщательно продезинфицировать руки спиртом.
Пробы отбирают стерильной пипеткой или стеклянной трубкой с оттянутым концом. При необходимости отбора проб из различных слоев вина или при отборе сверху из неполного резервуара пользуются резиновым шлангом, в который вставлена стеклянная трубка с оттянутым концом. Пробоотборник стерилизуют спиртом перед употреблением, предварительно промыв его водой.
Часто при микробиологическом контроле шампанского производства пробу отбирают через краны, имеющиеся в резервуарах и коммуникациях. В этом случае тщательно промывают кран, а поверхность закрытого крана обрабатывают спиртом или обжигают пламенем спиртовки (факела). Перед отбором пробы сливают от 2 до 10 куб. дм вина, в зависимости от наличия застойных зон в месте отбора пробы.
Отбор проб производится в стерильную посуду. Непосредственно перед взятием образца колбу освобождают от ватной пробки, обжигают горловину, наполняют жидкостью и, перед тем как закрыть, снова обжигают горловину и пробку. Жидкость в колбу наливают не более чем на 1/3 объема, с тем чтобы при случайной встряске не смачивалась ватная пробка. Кроме того непосредственно перед центрифугированием, микроскопированием или посевом жидкость необходимо тщательно перемешать, если только проба не отбиралась для анализа пленки или осадка.
Микробиологический анализ необходимо проводить непосредственно после взятия проб, но не позднее чем через 2 ч при условии хранения образцов при температуре 2 °С +/- 1 °С. При контроле количественного состава микроорганизмов анализ проводят не позднее чем через 20 мин. после взятия пробы.
Микробиологическое исследование проводят путем микроскопирования, а если необходим более углубленный микробиологический анализ, то проводят посевы на жидкие или твердые питательные среды (Приложение 4).
2.2. Техника микроскопирования
При микробиологическом исследовании основным прибором служит микроскоп. При длительной многочасовой работе удобны биологические микроскопы с бинокулярной насадкой и наклонным тубусом. С помощью микроскопов изучают морфологию и строение клеток микроорганизмов. В микробиологической практике обычно используют оптические светлопольные микроскопы, часто с фазово-контрастным устройством, и люминесцентную микроскопию.
Наиболее распространены и удобны для работы в заводских микробиологических лабораториях биологические микроскопы МБИ-3, МБИ-6, МББ-1, МЛ-2, БИОЛАМы отечественного производства с наибольшим увеличением в 1350 раз, определяемым произведением степени увеличения объектива на увеличение окуляра.
В микробиологической практике применяют много дополнительных приборов, облегчающих исследование: осветительную лампу ОИ-7, устройство для наблюдения методом фазовых контрастов КФ-4, устройство люминесцентное ОИ-17, окулярный и объективный микрометры, счетные камеры Горяева, Тома-Цейса и др.
Микроскоп должен быть установлен стационарно на устойчивом столе или кронштейнах. Нельзя держать микроскоп на освещенном солнцем и теплом месте, так как при этом нарушается соединение отдельных линз в оптической системе. Микроскоп хранят под колпаком или чехлом.
При естественном освещении пользуются плоской стороной зеркала, а при искусственном — вогнутой.
Для микроскопирования пользуются окулярами 7х, 10х, 15х, объективами 10х, 20х, 40х, 90х (иммерсионный).
Хорошие результаты при работе с микроскопом могут быть получены только при условии правильного освещения объекта. Лучший способ освещения основан на системе Келера, которым необходимо пользоваться независимо от того, вмонтирован ли источник света в основание микроскопа или применяется специальный осветитель. Установку света выполняют в такой последовательности:
• ставят микроскоп и осветитель на крестовину, что обеспечивает необходимое расстояние — 120 мм — между источником света и зеркалом микроскопа;
• на предметный столик помещают препарат;
• устанавливают объектив 10х;
• поднимают конденсор до упора и открывают полностью его диафрагму;
• ставят вогнутое зеркало и закрывают диафрагму осветителя, оставив небольшое отверстие;
• включают осветитель и придают его корпусу такое положение, при котором свет падал бы в центр поля зрения;
• кладут на зеркало микроскопа кружок белой бумаги и получают контрастное изображение витка нити осветителя, передвигая патрон лампы;
• уменьшив реостатом яркость лампы осветителя, глядя в окуляр, поворачивают зеркало, находят в поле зрения изображение краев диафрагмы осветителя, которое имеет вид светлого пятна с нечеткими краями, и переводят в центр осторожным поворотом зеркала;
• используя объектив 10х, фокусируют объектив в области светлого пятна, слегка опуская конденсор, получают в плоскости препарата четко очерченное изображение краев диафрагмы осветителя, а с помощью зеркала переводят его в центр поля зрения;
• открывают диафрагму осветителя не более чем на 2/3;
• устанавливают объектив 40х или 90х и фокусируют на объект.
Яркость освещения регулируют изменением накала лампы осветителя с помощью реостата. Положение зеркала, конденсора и диафрагмы осветителя после установки менять нельзя.
2.3. Светлопольная микроскопия
Светлопольные микроскопы позволяют исследовать объекты в проходящем свете. После установки света по Келеру на столик микроскопа ставят предметное стекло, зажимают его клеммами и при помощи макровинта опускают тубус до тех пор, пока объектив не коснется стекла. Затем постепенно поднимают тубус до появления изображения. Дальнейшую фокусировку производят микрометрическим винтом. При работе с иммерсионным объективом на препарат наносят каплю иммерсионного масла и объектив 90х опускают в масло до соприкосновения со стеклом. Медленно поднимают тубус, находят изображение.
Методом светлопольной микроскопии пользуются при подсчете клеток микроорганизмов в анализируемых образцах при помощи счетных камер, используя окуляр 7х или 10х, объектив 40х.
Светлопольную микроскопию можно использовать для изучения морфологии клеток микроорганизмов, предварительно окрашенных специальными красителями (реактив Люголя, судан III, метиленовая синь по Леффлеру и др.), а также для проверки чистоты анализируемой пробы (Приложение 5).
2.4. Микроскопия с фазово-контрастным устройством
Фазовый контраст является одним из совершенных и доступных методов повышения контрастности неокрашенных живых препаратов, позволяющих получать контрастное изображение, в котором темные и светлые места соответствуют различной толщине оптической плотности препарата.
Принцип фазовой микроскопии состоит в том, что с помощью специального конденсора с кольцевой диафрагмой различной величины, соответствующей различным объективам, производится изменение фазы проходящих через препарат световых лучей на четверть длины волны, в результате чего получается изображение объекта, в котором степень затемнения деталей прямо пропорциональна их толщине.
Для фазово-контрастной микроскопии нужно иметь: микроскоп любой марки, осветитель и фазово-контрастное устройство КФ-4.
При микроскопировании с фазовым контрастом в дрожжевых организмах обнаруживают резко очерченную оболочку, темную цитоплазму, светлые вакуоли, четко выраженные включения как в цитоплазме, так и в вакуолях. Иногда можно наблюдать ядра и хондриосомы. Кроме того, можно обнаружить изменения в клеточном протопласте, особенно его вакуолизацию, сжатие и отхождение от оболочки, появление зернистости, жировое перерождение.
Преимущество метода фазово-контрастной микроскопии заключается в том, что контраст создается только оптическим путем, без дополнительного окрашивания препаратов.
2.5. Люминесцентная микроскопия
Принцип люминесцентной микроскопии основан на способности микроорганизмов светиться под влиянием падающего на них света. Люминесценцию можно наблюдать с помощью обычного микроскопа, установив на пути яркого источника света к препарату синий светофильтр, пропускающий сине-фиолетовые лучи, вызывающие люминесценцию частей препарата, способных светиться. Синий свет, возбуждающий эту люминесценцию, значительно ярче люминесценции, поэтому он засвечивает поле зрения. Его убирают желтым светофильтром, который помещают на окуляр микроскопа, и наблюдатель видит на черном фоне люминесцирующие объекты. Для микробиологических исследований наиболее удобен люминесцентный микроскоп МЛ-2, выпускаемый отечественной промышленностью.
Однако большое значение приобретают приемы получения вторичной люминесценции. Любой микроскопический препарат можно превратить в ярко люминесцирующий, обработав его специальными красителями-флуорохромами, обладающими люминесценцией (Приложение 5).
Изучаемые структуры или исследуемые вещества ярко светятся различным светом на темном фоне.
Люминесцентная микроскопия широко применяется для выявления живых и мертвых клеток микроорганизмов и для изучения структуры дрожжевых клеток, динамики перестроек и изменений в протопласте в связи с функциональной активностью и условиями существования дрожжей.
Флуорохром должен свободно проникать внутрь объекта, связываться с его определенными структурами, придавая им характерное свечение, разнообразное по цвету и яркости.
Наиболее пригодными для прижизненной обработки микроорганизмов являются следующие флуорохромы:
• примулин, с помощью которого различают живые и мертвые клетки (последние ярко светятся). У живых клеток светится только оболочка, а внутреннее содержимое сливается с темным фоном;
• акридиновый оранжевый, относительно слабо связываясь с белками протоплазмы, придает им темно-зеленое свечение. Он накапливается в значительном количестве в ядре, где, соединяясь с ядерными нуклепротеидами, люминесцирует ярким светло-зеленым светом, соединяясь с рибонуклеиновой кислотой, образует гранулы, светящиеся огненно-красным светом. Вакуоли различимы как темные пятна;
• аурофосфин аккумулируется митохондриями, ярко светящимися золотистым светом на темном фоне.
2.6. Приготовление препаратов микроорганизмов
Микроорганизмы можно микроскопировать в живом или фиксированном (убитом) состоянии. Для препаратов применяют предметные стекла размером 76 х 26 мм, толщиной (1,2 +/- 0,2) мм, покровные стекла размером 18 х 18 мм или 24 х 24 мм и толщиной (0,16 +/- 0,01) мм. Новые предметные и покровные стекла ополаскивают теплой водой, кипятят 10 мин. в растворе соляной кислоты 0,25 — 0,50 моль/куб. дм, промывают водопроводной, а затем дистиллированной водой, потом кипятят 10 мин. в мыльной (хозяйственное мыло) дистиллированной воде и тщательно промывают дистиллированной водой. Стекла, бывшие в употреблении, ополаскивают теплой водой, кипятят 10 мин. в мыльной дистиллированной воде и тщательно промывают водопроводной, а затем дистиллированной водой. Предметные стекла сушат в сушильном шкафу и хранят в сосуде с плотной крышкой. Покровные стекла хранят в бюксах с этиловым спиртом с объемной долей 95%.
Клетки микроорганизмов для посева или приготовления препаратов берут бактериологической петлей, если микроорганизмы выращены на плотной среде; для взятия клеток из жидкой среды чаще используют стерильные пипетки.
Бактериологические петли делают, используя проволоку из платины или нихрома диаметром 0,2 — 0,4 мм, которую закрепляют в металлическом держателе или впаивают в стеклянную палочку. Конец проволоки загибают в виде плотно замкнутой петли.
Посевы микроорганизмов в стерильные среды осуществляют в изолированных помещениях, лучше в боксах (Приложение 3).
2.6.1. Приготовление препаратов живых клеток.
Препарат «раздавленная капля» используют для установления формы клеток микроорганизмов, их размеров, структуры, подвижности, характера размножения и способа спорообразования.
На обезжиренное предметное стекло наносят каплю исследуемого материала. Если микроскопируют культуру, выросшую на плотной питательной среде, на предметное стекло предварительно наносят каплю стерильной водопроводной воды, затем петлей переносят в нее небольшое количество исследуемой культуры, размешивают и плотно покрывают покровным стеклом. Капля с исследуемым материалом должна быть такой, чтобы после прижимания ее покровным стеклом жидкость не выступала из-под стекла. Избыток жидкости удаляют фильтровальной бумагой.
Для учета мертвых дрожжевых клеток, определения гликогена и других запасных веществ в дрожжах, а также для лучшего рассмотрения и определения бактериальной инфекции готовят препараты с прижизненной окраской (окрашенные микроорганизмы остаются живыми долгое время). Приготовление этого препарата аналогично приготовлению препарата «раздавленная капля», только вместо водопроводной воды на предметное стекло наносят каплю краски (метиленовый синий, раствор Люголя, нейтральный красный и др.) (Приложение 5).
Препарат «висячая капля» используют для наблюдения за подвижностью микроорганизмов, их размножением, образованием и прорастанием спор, отношением клеток к химическим раздражителям. Препарат готовят на специальном предметном стекле с углублением. Ободок лунки или края покровного стекла смазывают вазелином. На середину покровного стекла наносят маленькую каплю исследуемой суспензии, которое поворачивают каплей вниз и накрывают лунку. Капля должна свободно висеть, не касаясь краев дна лунки. Капля оказывается герметизированной во влажной камере, что допускает многодневное наблюдение за объектом.
2.6.2. Приготовление препаратов фиксированных клеток.
Фиксирование окрашенных препаратов используют для выявления морфологических особенностей микроорганизмов и для проверки чистоты культуры. Эти препараты могут храниться длительное время. Приготовление препарата включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску. На обезжиренное предметное стекло наносят исследуемый материал и краем покровного стекла равномерно распределяют его тонким слоем. Препарат сушат при комнатной температуре на воздухе или слегка нагревают над пламенем горелки, после чего фиксируют для того, чтобы обеспечить хорошее окрашивание, прилипание клеток к стеклу и предотвратить смывание препарата. Фиксируют микроорганизмы термической обработкой, для чего нижней стороной стекла 3 — 4 раза проводят над пламенем спиртовки. Фиксацию химическими веществами применяют при изучении строения бактериальной клетки, для чего препарат погружают на несколько минут в спирт, эфир или другие яды, которые смывают водой. После фиксации клетки микроорганизмов окрашивают анилиновыми красителями — метиленовым синим, основным фуксином, генциановым фиолетовым (Приложение 5). Фиксированный мазок покрывают фильтровальной бумагой и наливают на нее раствор красителя. Препарат выдерживают 1 — 3 мин., после чего снимают фильтровальную бумагу, промывают струей проточной воды и высушивают на воздухе.
Фиксированные препараты рассматривают при помощи иммерсионного объектива 90х без покровного стекла.
2.7. Методы определения количества клеток микроорганизмов
Количественный учет микроорганизмов необходим при микробиологическом контроле производственных процессов, санитарно-гигиеническом контроле и в научных исследованиях.
Микробиолог проводит общий подсчет дрожжевых клеток, дифференцированный подсчет мертвых и почкующихся клеток, а также инфицирующей микрофлоры при контроле поступающих виноматериалов, дрожжевой разводки из дрожжерастильных аппаратов, купажа до обескислороживания и после обескислороживания, бродильной смеси перед поступлением в бродильные аппараты шампанизируемого вина из пробоотборника, установок для шампанизации вина, готовой продукции для оценки правильности протекания технологических процессов, степени инфицирования на различных стадиях и необходимости исправления.
Учитывая количество микроорганизмов после мойки бутылок, коммуникаций, производственной тары и др., микробиолог дает заключение о чистоте мойки и необходимости повторной обработки.
Для определения общего количества микроорганизмов и учета представителей отдельных групп и видов микроорганизмов применяют ряд методов подсчета клеток:
• прямой подсчет клеток под микроскопом в одном поле зрения, в счетных камерах, на фиксированных окрашенных мазках, на мембранных фильтрах и др.;
• учет роста на питательных средах.
Прямой подсчет можно производить в поле зрения микроскопа и в счетной камере в единице объема.
Исследуемую жидкость тщательно взбалтывают не менее 1 мин., готовят препарат «раздавленная капля» и подсчитывают в 10 полях зрения общее число клеток по интересующему виду микроорганизмов или стадиям развития. Полученные среднеарифметические или выраженные в процентном отношении цифры количества микроорганизмов дают представление о составе микрофлоры в одном поле зрения.
Для определения количества клеток микроорганизмов в единице объема пользуются счетными камерами с сетками системы Горяева, Бюркера, Тома и др., одинаковыми по принципу их построения.
Счетная камера представляет собой толстое предметное стекло, разделенное бороздками на части. Центральная часть стекла ниже боковых на 0,1 мм, на ней нанесена сетка. В основе всех сеток лежит малый квадрат площадью 0,0025 кв. мм. Площадь большого квадрата сеток всегда соответствует площади 16 малых и равна 0,04 кв. мм. Сетка Горяева имеет 225 больших квадратов (15 х 15), занимающих площадь 9 кв. мм; эти цифры указаны на предметном стекле.
Обычно ведут подсчет в камерах с окуляром 7х или 10х и объективом 40х и 5 больших квадратах, расположенных по диагонали, т.е. по углам и в центре. Каплю исследуемой суспензии после тщательного взбалтывания, не менее 1 мин., сухой стеклянной палочкой или петлей наносят на сетку и покрывают шлифованным специальным покровным стеклом (18 х 18) толщиной 0,30 +/- 0,05 мм. Можно пользоваться обычными покровными стеклами (24 х 24) толщиной 1,16 +/- 0,01 мм, при необходимости делают разведение суспензии, так как в одном большом квадрате число клеток микроорганизмов не должно превышать 60 — 80, а в пяти квадратах — 400. Жидкость должна равномерно распределяться по поверхности сетки, без пузырьков. Покровное стекло прижимают большими пальцами к боковым площадкам камеры и притирают до появления радужных (ньютоновых) колец. При подсчете клеток культур дрожжей, образующих конгломераты, необходимо к исследуемой суспензии добавить равное количество серной кислоты с массовой концентрацией 10% и встряхивать не менее 5 мин. для разъединения скоплений клеток. При подсчете следует учитывать разбавление вдвое, сделанное раствором серной кислоты. Подсчет клеток начинают через 3 — 5 мин. после заполнения камеры, для того чтобы клетки осели и были видны под микроскопом в одной плоскости. Учитывают все клетки, лежащие в квадрате сетки, а также пересекающие верхнюю и правую стороны квадрата.
Концентрацию клеток вычисляют по формуле:
М = 50000 х а х n,
где:
М — число микроорганизмов в суспензии, млн. клеток/куб. см;
50000 — коэффициент пересчета объема пяти больших квадратов на 1 куб. см;
а — общее количество подсчитанных клеток микроорганизмов в пяти больших квадратах;
n — кратность разведения.
Прямой подсчет клеток на фиксированных окрашенных мазках дает возможность сохранять препараты длительный срок. На обезжиренное предметное стекло помещают определенный объем суспензии клеток, не более 0,05 куб. см, и равномерно распределяют на площади, равной 6 кв. см. Для этого удобно под предметное стекло подложить миллиметровую бумагу, на которой отмечен прямоугольник нужного размера. Препарат подсушивают на воздухе и фиксируют 10 — 20 мин. спиртом с объемной долей 96%. Затем препарат красят 1 — 2 мин. фуксином Циля, тщательно промывают водой и высушивают на воздухе. Подсчет клеток микроорганизмов проводят с иммерсионным объективом в квадратах окулярной сетки, которую вставляют в окуляр. Просчитывают не менее 10 полей зрения, передвигая препарат по диагонали. При отсутствии окулярной сетки можно подсчитывать клетки микроорганизмов на всей площади поля зрения микроскопа. Общее количество подсчитанных клеток должно быть не менее 600.
Площадь поля зрения определяют с помощью микрометра, который помещают
на столик микроскопа вместо препарата, и при том же увеличении, при котором
проводили подсчет клеток, измеряют сторону квадрата сетки (или диаметр поля зрения) и по формуле S = π * r2 вычисляют его площадь. Количество клеток, содержащихся в 1 куб. см суспензии, подсчитывают по формуле:
a х S х n
M = ——————————,
0,05 х s
где:
M — число микроорганизмов в исследуемой суспензии, млн. клеток/куб. см;
a — количество клеток в одном поле зрения;
S — площадь мазка, кв. мкм;
0,05 — объем взятой суспензии, куб. см;
n — кратность разведения;
s — площадь квадрата сетки, кв. мкм.
Высев на плотные среды (метод Коха) основан на том, что из каждой жизнедеятельной клетки микроорганизмов при посеве на плотную среду в чашку Петри развивается отдельная колония. Вместе с тем результаты определения этим способом численности микроорганизмов, образующих цепочки или конгломераты клеток, будут всегда несколько занижены. Чашечный метод позволяет учесть не только численность микроорганизмов в субстрате, но и оценить их разнообразие по морфологии колоний. Этот способ применяется при контроле чистоты воздуха и качества мойки оборудования.
При небольшом содержании микроорганизмов, не более 200 в 0,1 куб. см, делают посев в чашки Петри без предварительного разведения.
При значительной обсемененности анализируемую пробу разводят стерильным физиологическим раствором. Стерильной пипеткой переносят 1 куб. см исследуемого образца в пробирку с 9 куб. см стерильного физиологического раствора и получают разведение 1:10. Чтобы получить второе разведение — 1:100, берут 1 куб. см стерильного раствора. Полученную суспензию тщательно перемешивают, вбирая в пипетку и выпуская из нее взвесь не менее 3 — 5 раз. Таким же образом готовят и последующие разведения. Для приготовления каждого разведения следует использовать отдельную пипетку. Степень разведения зависит от предполагаемой обсемененности исследуемого образца.
Посев в чашки может быть поверхностным и глубинным. При поверхностном посеве на застывшую агаризованную среду наносят обычно 0,05 — 0,2 куб. см суспензии и стерильным шпателем равномерно распределяют ее на поверхности. Затем этим же шпателем проводят по всей поверхности во второй чашке, куда посевной материал не вносили. Из каждого разведения делают 2 — 3 параллельных высева, пользуясь каждый раз отдельным шпателем. Чашки с засеянными средами помещают в термостат с температурой (26 +/- 2) °С, благоприятной для развития выявляемых микроорганизмов.
При глубинном посеве 0,1 куб. см исследуемой среды тщательно перемешивают с 15 куб. см расплавленной питательной среды в чашке Петри. Для получения достоверных результатов каждый посев делают на 2 — 3 чашки. Засеянные и застывшие чашки термостатируют, помещая в термостат крышками вниз. Через 3 — 5 сут. подсчитывают выросшие колонии, суммируя посев на двух чашках. Результаты параллельных высевов суммируют и определяют среднее число колоний, выросших на одной чашке. Количество клеток в 1 куб. см исследуемого образца вычисляют по формуле:
а х 102
М = ————————————,
v
где:
М — число микроорганизмов в суспензии, млн. клеток/куб. см;
10 — коэффициент разведения;
n — кратность разведения;
а — среднее число колоний на одной чашке;
v — объем высеваемой суспензии, куб. см.
Лучшим разведением считается то, при высеве из которого выросло от 50 до 150 колоний. Следует иметь ввиду, что достоверность результатов зависит не только от числа повторностей, но и от точности подсчета колоний. Чашечный метод количественного учета микроорганизмов наиболее широко распространен в микробиологической работе. Несмотря на кажущуюся простоту выполнения, он требует от микробиолога предельного внимания и аккуратности.
2.8. Определение микробной стойкости вин
Гарантированная стойкость вин к микробным видам помутнений обеспечивается лишь при отсутствии в вине живых клеток. Факторами, стимулирующими микробное помутнение, могут быть температура, кислород, повышение величины рН, наличие углеводов, азотистых веществ, витаминов, сернистой кислоты и др.
Микробную стойкость вина определяют по времени развития микроорганизмов в пробе вина.
Отбор пробы проводят стерильно от однородной партии вина или каждой емкости согласно ГОСТ 14137-74 «Вино, виноматериалы, коньяки и коньячные спирты. Правила приемки и методы отбора проб». От средней пробы отбирают 10 куб. см вина, после центрифугирования осадок микроскопируют. Обработанное и подготовленное к розливу вино не должно содержать в среднем более 2 клеток микроорганизмов в 10 полях зрения. При наличии большего количества микроорганизмов определяют его микробиологическое состояние по отношению к дрожжам и уксуснокислым бактериям, для чего исследуемую пробу вина в пробирке с ватной пробкой помещают в термостат с температурой (26 +/- 2) °С. Наблюдение за развитием дрожжей и уксуснокислых бактерий в вине ведут в течение 6 сут. Вино считается стойким, если только на четвертые сутки обнаружен рост винных или пленчатых дрожжей и если на пятые и шестые сутки не обнаружены уксуснокислые бактерии. Неудовлетворительным считается вино, если рост бактерий и пленчатых дрожжей появился на первые или вторые сутки, в остальных случаях — нестойким.
Кроме того, определяют микробиологическое состояние по отношению к молочнокислым бактериям. Среднее количество клеток определяют микроскопированием в 10 полях зрения осадка после центрифугирования 10 куб. см вина. Вино считается инфицированным, если количество молочнокислых бактерий составляет более 3 клеток в поле зрения, сильно инфицированным — более 6, неудовлетворительным — более 15, причем появляются посторонний тон и привкус при массовой концентрации летучих кислот более 1,2 г/куб. дм.
Микробиологическое состояние вина, инфицированного молочнокислыми бактериями, можно определить и путем посева пробы вина в количестве 0,5 куб. см в питательные среды со спиртом или в солодовое сусло с нистатином (Приложение 3).
Наблюдения за развитием молочнокислых бактерий начинают через 3 сут. после высева и ведут не менее 7 сут. при высеве в среду с нистатином и не менее 15 сут. при высеве в среду со спиртом. Вино считается стойким, если на среде с нистатином не обнаружено роста бактерий на седьмые сутки и на среде со спиртом — на пятнадцатые сутки. В случае помутнения среды на третьи сутки вино считается инфицированным, а вино с наличием летучих кислот с массовой концентрацией свыше 1,2 г/куб. дм и посторонним тоном — неудовлетворительным. Нестойкое вино сульфитируют из расчета массовой концентрации свободной сернистой кислоты в вине от 20 до 25 мг/куб. дм и ведут за ним постоянный микробиологический контроль. Неудовлетворительное вино оклеивают и фильтруют, после чего пастеризуют при температуре 80 °С в течение 15 мин. и сульфитируют из расчета массовой концентрации свободной сернистой кислоты в вине от 20 до 25 мг/куб. дм. Дальнейшее хранение обработанных вин не рекомендуется.
Инфицированное молочнокислыми бактериями вино с высокой титруемой кислотностью проверяют на наличие яблочной кислоты и при необходимости проводят яблочно-молочное брожение.
2.9. Методы контроля санитарно-гигиенического состояния производства
Бутылки. Отобранные для анализа 2 бутылки закрывают ватными пробками. Затем в каждую из них вносят по 50 куб. см стерильной водопроводной воды. После энергичного взбалтывания смывную воду переносят в простерилизованные центрифужные пробирки и центрифугируют 10 — 15 мин. при 3000 — 5000 об./мин. Затем жидкость сливают, а последнюю каплю микроскопируют.
Более точным методом определения чистоты бутылок является посев на твердую питательную среду. Для этого 1 куб. см смывной воды стерильно переносят в чашку Петри со средой и термостатируют при 25 °С в течение 3 — 6 сут. После выращивания посевов определяют общее количество микроорганизмов в 1 куб. см смывной воды и делают пересчет на одну бутылку, умножая количество подсчитанных колоний на объем смывной воды (50 куб. см).
Пробки. Для микробиологического анализа стерильным пинцетом отбирают три пробки в стерильную широкогорлую колбу и заливают стерильной водопроводной водой объемом 50 куб. см. Колбу закрывают ватной пробкой и сильно встряхивают в течение 5 мин. Смывную воду готовят для микроскопирования так же, как при контроле бутылок.
Сыпучие материалы (оклеивающие вещества, танин, сахароза и др.). Отбирают среднюю пробу с массой не менее 100 г от партии из разных мест упаковки с помощью стерильного шпателя или ложки, переносят в стерильную посуду и тщательно перемешивают. В колбу с 10 куб. см стерильной водопроводной воды вносят 1 г этого материала. После 5 мин. встряхивания пробу центрифугируют и микроскопируют.
Воздух. Бактериологическое исследование воздуха производственных помещений проводят методом оседания, основанным на седиментации микробных клеток на поверхности агара в открытой чашке Петри. Для этого в стерильные чашки Петри разливают агаризованную среду. После затвердевания среды завернутые в стерильную бумагу чашки Петри переносят в цех для исследования. В помещении чашку открывают и кладут на горизонтальную поверхность. В зависимости от предполагаемого бактериального загрязнения чашку выдерживают 5, 10, 15 мин., а затем ставят в термостат на 3 — 5 сут. при температуре 25 °С и подсчитывают выросшие колонии. В 1 куб. м воздуха должно содержаться не более 1000 клеток микроорганизмов.
Установлено, что в течение 5 мин. на чашку площадью 100 кв. см оседает столько микроорганизмов, сколько их содержится в 10 куб. дм воздуха. Исходя из этого рассчитывают количество микроорганизмов в 1 куб. м воздуха по формуле:
A х 5 х 100
х = ——————————————- х 100,
S K
где:
х — число микроорганизмов в воздухе, млн. клеток/куб. м;
100 — число для пересчета площади чашки, кв. см;
100 — число для пересчета 10 куб. дм воздуха в 1 куб. м;
A — количество колоний, выросших в чашке Петри;
S — площадь чашки, кв. см;
K — временной коэффициент (если чашка открыта 5 мин. — 1, 10 мин. — 2, 15 мин. — 3).
Этот метод не дает точных количественных показателей загрязненности воздуха, но при одинаковых условиях анализа можно получить сравнительные данные. Для контроля необходимо проводить анализ воздуха во дворе завода (в летнее время, после поливки двора). Количество микроорганизмов в воздухе производственных помещений не должно превышать количества микроорганизмов в наружном атмосферном воздухе.
При анализе воздуха, поступающего в дрожжевые аппараты, не всегда имеется возможность внести чашку Петри в воздуховод с обеспложенным воздухом. В этом случае используют колбу типа промывалки. На дно колбы наливают 10 — 12 куб. см агаризованной питательной среды и вместе с резиновой трубкой, закрытой ватной пробкой, стерилизуют в автоклаве. После застывания питательной среды колбу через резиновую трубку присоединяют к воздуховоду. Воздух пропускают через колбу в течение 2 ч, после чего колбу закрывают ватной пробкой и помещают в термостат на 3 — 5 сут. при 25 °С.
Качество очистки воздуха, подаваемого в дрожжевые аппараты, можно также проверить путем его барботирования (пропускания) в течение 2 ч через колбу со стерильной водопроводной водой и последующим посевом 1 куб. см на агаризованную питательную среду. Улавливание микробных клеток проводят, подсоединяя колбу к обводной линии воздуховода после фильтра. Таким же методом анализируют двуокись углерода газообразную, но время пропускания газа ограничивают 20 мин.
Оборудование (резервуары, фильтры, насосы, коммуникации, разливочные автоматы и др.). Непосредственно после промывки оборудования отбирают пробу последней смывной воды через спускной кран в стерильную пробирку, предварительно слив несколько литров воды. При невозможности отбора из крана смывную воду берут со дна резервуара стерильной пипеткой через люковое отверстие. 10 куб. см смывной воды центрифугируют в течение 10 — 15 мин. при 3000 — 5000 об./мин. и микроскопируют.
Мазки с поверхности оборудования берут стерильным ватным тампоном, смоченным в стерильной водопроводной воде. При помощи пинцета тампон увлажняют в колбе с 50 куб. см стерильной воды, протирают им поверхность площадью около 100 кв. см и переносят в ту же колбу. После тщательного взбалтывания воду центрифугируют и микроскопируют.
При проверке шлангов, не содержащих смывной воды, через них пропускают 1 — 2 куб. дм водопроводной воды. Эту воду собирают в стерильную колбу (первые порции используют для промывания краев шланга). 10 куб. см смывной воды центрифугируют и микроскопируют. Для получения более точных данных о качестве обработки и мойки оборудования можно производить посевы 1 куб. см смывных вод на твердую питательную среду.
2.10. Методы дезинфекции
В зависимости от применяемого агента различают физические и химические методы дезинфекции. К физическим методам относятся: нагревание (обработка паром, кипячение), обеспложивающая фильтрация, действие ультразвука, облучение и др. В промышленности используется в основном дезинфекция нагреванием. Большинство неспорообразующих микроорганизмов погибают при нагревании до температуры 60 — 70 °С в течение 10 — 20 мин. Некоторые бактерии и споры микроорганизмов более устойчивы к воздействию высокой температуры и не погибают при нагревании до температуры 80 — 90 °С.
Эффективным методом является пропаривание оборудования насыщенным паром. Имеет значение и способ подачи пара. При пропускании пара струей через коммуникации микроорганизмы уничтожаются уже через 5 — 10 мин.
Для частичного уничтожения микроорганизмов применяют горячую воду. Воздействие горячей воды на оборудование и инвентарь при температуре 80 — 85 °С в течение 20 — 30 мин. оказывается эффективным. Бактерицидное действие горячей воды усиливается при ее подщелачивании.
К химическим методам дезинфекции относится применение различных антисептиков. Перед их использованием необходимо провести механическую очистку аппаратуры. После дезинфекции все обработанное оборудование и коммуникации тщательно промывают водой до полного удаления агента. Необходимо использовать только свежеприготовленные дезинфицирующие растворы.
Дезинфицирующее средство выбирают в зависимости от степени инфицирования объекта, материала оборудования, степени изношенности, его размеров.
Практическое применение нашли следующие вещества: раствор перманганата калия с массовой концентрацией 2,5 г/куб. дм, сернистый ангидрид, раствор кальцинированной соды с массовой концентрацией до 20 г/куб. дм, раствор каустической соды с массовой концентрацией 1 г/куб. дм, раствор хлорной извести с массовой концентрацией 20 г/куб. дм и антиформин.
Эффективность действия хлорной извести определяется массовой долей в ней активного хлора. При хранении под действием тепла и света известь разлагается, содержание активного хлора и антимикробное действие ее снижаются.
Массовую долю активного хлора определяют следующим образом. 10 г средней пробы хлорной извести растирают в ступке с небольшим количеством воды, смесь переносят в колбу вместимостью 1 куб. дм и доливают водой до метки. После тщательного перемешивания отбирают 100 куб. см, прибавляют к смеси 1 — 2 г йодистого калия и 10 — 20 капель соляной кислоты (плотностью 1,19). Выделившийся йод титруют раствором гипосульфита с молярной концентрацией 0,1 моль/куб. дм в присутствии крахмала. 1 куб. см раствора гипосульфита с массовой концентрацией 1 г/куб. дм соответствует 0,0035 г хлора.
Массовую долю активного хлора вычисляют по формуле:
х = 0,0035 х n х 100,
где:
х — массовая доля активного хлора, %;
0,0035 — коэффициент пересчета объема израсходованного на титрование гипосульфита в массовую долю активного хлора;
100 — коэффициент для выражения массовой доли хлора, %;
n — объем раствора гипосульфита концентрацией 0,1 моль/куб. дм (0,1 н раствор), израсходованного на титрование, куб. см.
Активным дезинфектантом является антиформин. Его готовят из хлорной извести, кальцинированной и каустической соды. Готовят три отдельных раствора: 5 кг хлорной извести растворяют в 150 куб. дм воды; 10 кг кальцинированной соды растворяют в 20 куб. дм горячей воды при температуре 65 — 70 °С; 2,5 кг каустической соды растворяют в 12 куб. дм воды. Первый и второй растворы соединяют, хорошо перемешивают и выливают в раствор каустической соды. Затем антиформин оставляют на 7 сут. до полного осветления, раствор декантируют и разводят в 15 — 20 раз водой для получения рабочего раствора.
Контроль эффективности дезинфицирующих растворов проводят следующим образом. В пробирку заливают 10 куб. см исследуемого раствора и прибавляют 1 куб. см дрожжевой разводки. После тщательного взбалтывания ее оставляют на 2 ч, после чего делают посевы на жидкую и твердую питательные среды. Посевы выдерживают при температуре 25 °С в течение 3 — 6 сут. Раствор антисептика считается активным, если не обнаруживается рост микроорганизмов.
Приложение 1
(рекомендуемое)
СПИСОК ОБОРУДОВАНИЯ, ПОСУДЫ И РЕАКТИВОВ МИКРОБИОЛОГИЧЕСКОЙ ЛАБОРАТОРИИ (ИЗ РАСЧЕТА МОЩНОСТИ ПРЕДПРИЯТИЯ 5 МЛН. БУТЫЛОК В ГОД)

Приложение 2
(обязательное)
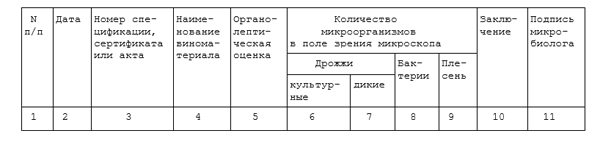
ЖУРНАЛ ТХМК N 1
МИКРОБИОЛОГИЧЕСКИЙ КОНТРОЛЬ ПОСТУПИВШИХ ВИНОМАТЕРИАЛОВ
ЖУРНАЛ ТХМК N 2
МИКРОБИОЛОГИЧЕСКИЙ КОНТРОЛЬ ТЕХНОЛОГИИ ПРОЦЕССОВ ПРОИЗВОДСТВА ШАМПАНСКОГО
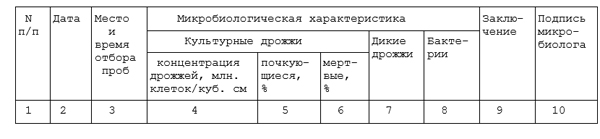
ЖУРНАЛ ТХМК N 3
МИКРОБИОЛОГИЧЕСКИЙ КОНТРОЛЬ ДРОЖЖЕВОЙ РАЗВОДКИ
ЖУРНАЛ ТХМК N 4
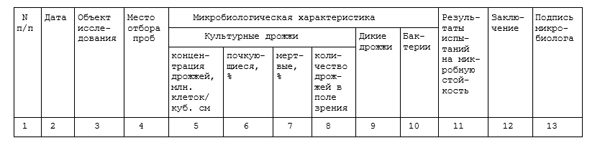
МИКРОБИОЛОГИЧЕСКИЙ КОНТРОЛЬ ГОТОВОЙ ПРОДУКЦИИ
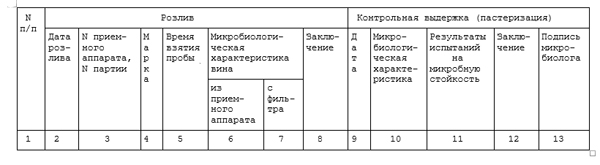
ЖУРНАЛ ТХМК N 5
МИКРОБИОЛОГИЧЕСКИЙ КОНТРОЛЬ ОБОРУДОВАНИЯ, ТАРЫ И ВСПОМОГАТЕЛЬНЫХ МАТЕРИАЛОВ
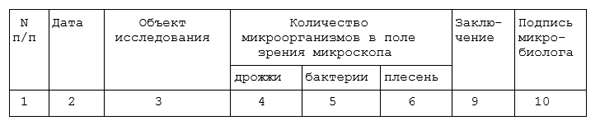
Приложение 3
(обязательное)
ПОДГОТОВКА ПОМЕЩЕНИЙ ДЛЯ МИКРОБИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
Микробиологический контроль производства проводят в отдельном помещении с изолированным боксом для посевов в стерильные среды. Стены окрашивают в светлые тона на всю высоту масляной краской, чтобы их можно было мыть. Полы покрывают линолеумом. Помещения обеззараживают протиранием всех поверхностей дезинфицирующими препаратами, чаще всего раствором хлорамина с массовой концентрацией 0,5%. Особенно тщательно следует дезинфицировать поверхность стола, на котором проводится работа с микроорганизмами, как перед началом работы, так и после окончания. Рекомендуется также протирать поверхности ватным тампоном, смоченным раствором этилового спирта с объемной долей 70%.
Перед началом работы бокс облучают бактерицидной лампой БУВ-15 или БУВ-30 в течение 30 мин. (пребывание людей в помещении с включенной бактерицидной лампой запрещается).
Для проведения микробиологического контроля в микробиологической лаборатории должно быть необходимое оборудование, посуда, вспомогательные материалы, а также химические реактивы.
Приложение 4
(обязательное)
ПРИГОТОВЛЕНИЕ ПИТАТЕЛЬНЫХ СРЕД
Питательные среды используют для воспроизводства и поддержания чистой культуры дрожжей, а также с целью выявления и идентификации сопутствующей микрофлоры. Используются жидкие и плотные питательные среды.
Вино с сахаром готовят из белого сухого вина или обработанного купажа виноматериалов с добавлением резервуарного ликера или сахарозы до массовой концентрации сахара в среде от 20 до 50 г/куб. дм и подвергают пастеризации. Среда используется для выращивания дрожжей и бактерий.
Виноградное сусло с целью освобождения от белковых веществ нагревают до кипения, фильтруют и подвергают пастеризации. Среда используется для выращивания дрожжей и бактерий.
Солодовое сусло готовят из неохмеленного пивного сусла путем разбавления водопроводной водой до получения раствора с массовой долей сухих веществ 7 — 8% и стерилизуют в течение 30 мин. при температуре 116 +/- 1 °С. Среда используется для выращивания дрожжей и бактерий.
Дрожжевую воду готовят путем кипячения в течение 30 мин. 100 г пекарских прессованных или 10 г сухих дрожжей в 1 куб. дм воды, затем дают отстояться на холоде в течение 12 ч; надосадочную жидкость фильтруют. К фильтрату добавляют 1 куб. дм воды, кипятят 30 мин. и вновь фильтруют. После доведения рН до нужного значения жидкость стерилизуют 30 мин. при температуре 116 +/- 1 °С. Среда используется для выращивания дрожжей и бактерий.
Дрожжевой автолизат готовят из свежих прессованных дрожжей. 100 г дрожжей заливают 500 куб. см воды, перемешивают, добавляют толуол для предотвращения инфицирования и выдерживают 2 сут. в термостате при температуре от 58 до 60 °С. Полученный автолизат тщательно перемешивают, кипятят и фильтруют через воронку Бюхнера с бумажной мезгой. Стерилизуют 15 мин. при температуре 116 +/- 1 °С. Автолизат добавляют к питательным средам в качестве стимулятора роста дрожжей и бактерий в таком количестве, чтобы массовая концентрация аминного азота в среде составляла от 0,05 до 0,3 г/куб. дм. Автолизат можно использовать как самостоятельную питательную среду для молочнокислых бактерий после разбавления водой в соотношении 1:10 и добавления сахара из расчета массовой концентрации 20 г/куб. дм.
Среды с антибиотиками используют для выращивания дрожжей и подавления роста сопутствующих бактерий. С этой целью в питательные среды вводят пенициллин совместно со стрептомицином по 100 ед./куб. см каждого из компонентов.
Для подавления роста молочнокислых бактерий и развития уксуснокислых готовят питательные среды с мономицином, добавляя 20 ед./куб. см среды.
Капустная среда. 200 г размельченной свежей капусты добавляют в 1 куб. дм водопроводной воды, смесь доводят до кипения, кипятят в течение 10 — 14 мин. Фильтруют через ватно-марлевый фильтр. Полученный фильтрат разводят водой в два раза, добавляют к нему 20 г глюкозы и 10 г пептона. Стерилизуют в течение 30 мин. при температуре 121 +/- 1 °С. Среда предназначена для накопления и выделения молочнокислых бактерий.
Среды с этиловым спиртом используют для высева из вина молочнокислых бактерий и подавления роста дрожжей. Для этого в приготовленные стерильные питательные среды добавляют этиловый спирт с объемной долей его в среде 14%.
Физиологический раствор. 0,85 г хлористого натрия растворяют в 100 куб. см дистиллированной воды и стерилизуют при температуре 121 +/- 1 °С в течение 20 мин.
Плотные питательные среды получают добавлением в жидкие среды агара из расчета массовой доли 20 г/куб. дм. В кислых средах (при рН меньше 5,0) агар теряет гелеобразующую способность. В этом случае водный раствор агара стерилизуют отдельно от среды. Для приготовления плотной среды расплавленный водный раствор агара с массовой концентрацией 40 г/куб. дм и жидкую питательную среду смешивают при температуре от 60 до 70 °С в равных количествах над пламенем горелки. После перемешивания разливают стерильно в чашки Петри или в пробирки.
Для получения «косого агара» в пробирках их заполняют расплавленной средой на 1/3 высоты, стерилизуют и перед посевом «скашивают», предварительно расплавив.
Приложение 5
(обязательное)
ПРИГОТОВЛЕНИЕ КРАСИТЕЛЕЙ
Метиленовый синий — для прижизненного окрашивания микроорганизмов и клеточных включений готовят растворением 3 г краски в 100 куб. см этилового спирта с объемной долей 96%. Через 2 — 3 дня из него готовят разбавленные водные растворы с соотношением 1:10; 1:40; 1:300. Эти растворы не стойки.
Метиленовый синий Леффлера — для прижизненного окрашивания микроорганизмов. 3 г красителя растворяют в 100 куб. см этилового спирта с объемной долей 96%, настаивают 2 — 3 сут. при взбалтывании. Затем к 30 куб. см этилового спирта добавляют 100 куб. см воды и 1 куб. см раствора гидроокиси калия с массовой концентрацией 10 г/куб. дм. Этот раствор повышает красящую способность при длительном хранении.
Раствор Люголя — для прижизненного окрашивания микроорганизмов и окраски по Граму. 2 г йодистого калия растворяют в 5 — 10 куб. см воды, добавляют 1 г кристаллического йода, оставляют на несколько часов до полного растворения йода и после этого доводят объем раствора до 300 куб. см. Хранят в темной посуде.
Раствор красителя судан III — для окраски жировых включений. Для приготовления красителя 0,1 г судана III растворяют в 200 куб. см этилового спирта с объемной долей 96%.
Примулин используют для выявления мертвых клеток.
Акридионовый оранжевый и аурофосфин применяют для окрашивания клеточных структур. Исходные растворы этих красителей готовят с массовой концентрацией 0,01 г/куб. дм, а определение ведут при разведении этих растворов в 10 или 100 раз.
Фуксин основной. Насыщенный раствор: 10 г фуксина растворяют в 100 куб. см этилового спирта с объемной долей 96%. Для окраски клеток бактерий 10 — 20 куб. см насыщенного раствора приливают к 100 куб. см воды.
Карболовый фуксин Циля. К 10 куб. см насыщенного спиртового раствора фуксина основного прибавляют 5 г фенола (карболовой кислоты) и постепенно разбавляют 100 куб. см воды. Через 24 ч раствор фильтруют.
Генцианвиолет карболовый для окраски по Граму готовят растворением 1 г краски в 10 куб. см этилового спирта с объемной долей 96%. После полного растворения краски этот раствор смешивают со 100 куб. см водного раствора фенола с массовой концентрацией 50 г/куб. дм.
Приложение 6
(обязательное)
СТЕРИЛИЗАЦИЯ ПОСУДЫ И ПИТАТЕЛЬНЫХ СРЕД
Посуду перед стерилизацией моют, сушат и завертывают в бумагу для сохранения стерильности. Пробирки предварительно закрывают ватными пробками, в пипетки закладывают ватные тампоны. Чашки Петри, пробирки, пипетки заворачивают в бумагу отдельно или по несколько штук. Можно использовать металлические или картонные пеналы.
Среды, предназначенные для стерилизации под давлением, наливают в сосуды не выше половины их высоты. Сосуды со средой закрывают ватными или ватно-марлевыми пробками, поверх которых надевают бумажные колпачки.
Можно проводить термическую или холодную стерилизацию. Термическую стерилизацию осуществляют одним из способов: сухим жаром, прокаливанием в открытом пламени, паром под избыточным давлением, текучим паром.
Сухим жаром в сушильном шкафу стерилизуют стеклянную посуду и инструменты при температуре от 160 до 170 °С в течение 1,5 — 2,0 ч. Хранить стерильную посуду следует в закрытом, защищенном от пыли месте.
Мелкие металлические предметы (иглы, петли, скальпели, пинцеты и т.д.), а также предметные стекла прокаливают в пламени горелки.
Стерилизацию насыщенным паром под давлением осуществляют в автоклаве. Режим автоклавирования выбирают в зависимости от свойств стерилизуемого объекта.
Стеклянную посуду, шланги, фильтры Зейтца, пробки стерилизуют в автоклаве при температуре 121 +/- 1 °С в течение 20 мин. с последующим подсушиванием.
Жидкие и агаризованные среды, не содержащие сахаров и других веществ, разлагающихся при температуре 121 °С, а также воду стерилизуют в автоклаве при температуре 121 +/- 1 °С в течение 20 мин. Среды с сахарами и другими соединениями, не выдерживающими нагревания при высокой температуре, стерилизуют 20 мин. при температуре 110 +/- 1 °С.
Среды, изменяющие свой состав при нагревании выше температуры 100 °С и избыточном давлении, подвергают дробной стерилизации текучим паром при 3-разовом кипячении по 30 — 45 мин. через 1 сут.
Пастеризацию, т.е. неполную стерилизацию, используют для обеспложивания сред, не выдерживающих кипячения (вино, виноматериалы). Среды пастеризуют при температуре 75 — 80 °С в течение 15 мин. Пастеризованные среды хранят на холоде.
Для стерилизации жидкостей, которые изменяют свои свойства при нагревании, можно использовать холодную стерилизацию, заключающуюся в фильтровании через обеспложивающие микропористые фильтры, устройство и материал которых обеспечивают задержку микроорганизмов (асбестовые фильтры Зейтца, керамические, порошковые, прессованные или мембранные фильтры).
Приложение 7
(рекомендуемое)
СЕЛЕКЦИЯ, ВЫДЕЛЕНИЕ ЧИСТЫХ КУЛЬТУР ДРОЖЖЕЙ И ХРАНЕНИЕ ПРОИЗВОДСТВЕННЫХ ШТАММОВ
Производство шампанских вин является той отраслью виноделия, в которой ведущая роль для получения высококачественного продукта принадлежит дрожжам и продуктам их метаболизма.
Сложение своеобразного гармоничного вкуса и тонкого букета шампанского обусловливается сложными биохимическими и микробиологическими процессами взаимодействия дрожжей с шампанизируемым вином. Они катализируются комплексом ферментных систем, которые синтезируются дрожжевыми клетками.
Селекционированные шампанские дрожжи должны обладать комплексом ценных свойств:
• быть жизнедеятельными при высокой активной кислотности среды (рН 2,8 — 3,2) и объемной доле спирта 10 — 12%;
• устойчивыми по отношению к сернистому ангидриду (концентрация сернистого ангидрида в среде до 200 мг/куб. дм);
• холодостойкими, способными развиваться при температуре 10 — 12 °С и обеспечивать энергичное брожение с доведением давления диоксида углерода до 500 кПа при температуре 10 °С;
• выбраживание сахара должно проходить в регламентированные сроки, а вино после брожения быстро и полно осветляться.
Для шампанизации вина классическим бутылочным способом рекомендуются дрожжи с хлопьевидной структурой осадка, а для резервуарной шампанизации — с пылевидной.
Дрожжи шампанского производства должны образовывать ценные продукты брожения, обусловливающие свежий гармоничный вкус и аромат, характерные для шампанского, без посторонних привкусов, запахов и с минимальным количеством нежелательных соединений, в частности летучих кислот и их эфиров.
Характер и направленность процесса шампанизации во многом зависят от правильного выбора культуры дрожжей, ее физиологических и биохимических особенностей, состава вина и условий производства. Поэтому селекция наиболее эффективных рас дрожжей и рациональное регулирование их жизнедеятельности по ходу технологического процесса играют ведущую роль в создании продукции высокого качества. Для получения дрожжевых культур, отвечающих этим требованиям, необходимо систематически вести работу по селекции и направленному воспитанию дрожжей с целью повышения их производственных качеств. Одним из способов направленного улучшения производственно ценных признаков дрожжей является их многократное проведение через процесс производственной шампанизации с непрерывно улучшаемым отбором. Для этого из бродильного аппарата, в котором созданы все необходимые условия для приобретения дрожжами ценных производственных свойств, выделяют культуры дрожжей методом высева в чашки Петри на твердую питательную среду последующей отвивкой выросших колоний.
Объективным критерием оценки и ведущим признаком при селекции дрожжей шампанских рас является ряд физиологических, биохимических и физико-химических показателей, при условии, что избранная культура в процессе шампанизации в количественном отношении превалирует над сопутствующей микрофлорой.
Чистой культурой микроорганизмов называют культуру, полученную из одной клетки. При использовании в производстве чистых культур дрожжей улучшается качество получаемого продукта, уменьшается возможность появления посторонних тонов в букете и вкусе, несвойственных шампанскому. Брожение проходит более равномерно, и шампанское получается однородным по качеству.
Существует несколько методов получения чистых культур. Все они основаны на выделении из популяции единичной клетки. Чаще других используют метод Коха, заключающийся в получении чистой культуры из отдельной колонии, которую считают результатом развития одной клетки. Для получения изолированных колоний суспензию с микроорганизмами высевают на поверхность плотной питательной среды. Рассев проводят при помощи петли штрихом. Изолированные колонии штаммов дрожжей шампанской расы, относящиеся к факультативным анаэробам, лучше получать при глубинном посеве. Выделение чистой культуры анаэробных микроорганизмов по методу Коха требует создания условий, ограничивающих доступ кислорода к культуре. Для этого делают разведения суспензии с микроорганизмами в пробирках с 10 куб. см стерильной водопроводной воды, дважды пересевая одной петлей из пробирки в пробирку. Затем делают высев петлей в предварительно расплавленную и остуженную до температуры 45 — 50 °С агаризованную среду. Засеянный агар в пробирке перемешивают и выливают в чашку Петри. После застывания агара поверхность среды в чашках заливают смесью парафина и вазелинового масла (1:1) и выдерживают в течение нескольких дней при температуре 15 °С. Посев повторяют 2 — 3 раза. В качестве посевного материала используют культуры, полученные из отдельной колонии.
Можно получать изолированные колонии, пользуясь поверхностным посевом на застывшую агаризованную среду в чашках Петри. Посев необходимо повторять 2 — 3 раза, так как возможен рост колоний из нескольких слипшихся клеток.
Для проверки чистоты выделенных культур просматривают колонии выросших микроорганизмов, отмечают, описывают и зарисовывают преобладающие формы, выбирая изолированные колонии. Каждую из описанных колоний отсевают в пробирки с жидкой питательной средой и на поверхность скошенной агаризованной среды.
Чистоту выделенных культур проверяют визуально, микроскопированием и рассевом на поверхность агаровой пластинки в чашках Петри. Визуально просматривают рост по штриху на скошенной агаризованной среде. Культуры, рост которых однороден по всему штриху, оставляют для дальнейшей работы, а культуры неоднородные по штриху отбрасывают. С помощью микроскопического контроля препарата «раздавленная капля», лучше с фазово-контрастным устройством, выявляют однородность культуры. Чистые культуры дрожжей должны быть морфологически однородны, допустимо лишь некоторое варьирование размеров клетки. После посева изолированных колоний в пробирки на поверхность скошенной агаризованной среды готовят суспензии этих культур смывом стерильной водопроводной воды. Полученную суспензию подвергают микроскопическому контролю и после разведения рассевают на поверхность агаровой среды в чашки Петри. Через 5 — 7 сут. термостатирования при температуре 30 °С просматривают колонии, выросшие в чашках, и сверяют их признаки с отмеченными при выделении. Однородность колоний и совпадение их признаков с описанными ранее — свидетельство чистоты культуры.
Выделенные отселекционированные производственные штаммы чистых культур дрожжей должны храниться в коллекции микробиологической лаборатории заводов шампанских вин. В производстве можно применять только те расы, которые проверены и рекомендованы Отраслевой лабораторией технологии игристых вин Всероссийского научно-исследовательского института пивоваренной безалкогольной и винодельческой промышленности.
Культуры дрожжей должны сохраняться в условиях, максимально приближенных к производственным и обеспечивающих их чистоту. Несоблюдение этих условий может привести к частичной утрате присущих дрожжам производственно ценных свойств и к загрязнению культуры посторонними микроорганизмами. Такие условия легко создать в любой лаборатории. Питательной средой для хранения чистых культур дрожжей в музее в течение длительного времени должна быть только жидкая среда — купаж шампанских виноматериалов или белое сухое вино с добавлением ликера до массовой концентрации сахара от 20 до 30 г/куб. дм.
Культуры хранят в аптечных склянках вместимостью 30 — 50 куб. см с навинчивающимися пластмассовыми пробками. Для этого предварительно пастеризованную питательную среду наливают по 10 — 15 куб. см в стерильные склянки и пересевают в них по 0,5 куб. см чистой культуры дрожжей последней генерации в стадии бурного брожения. Отверстия склянок сразу же закрывают простерилизованными спиртом плоскими резиновыми пробками, завинчивают пластмассовыми колпачками и хранят в холодильнике при температуре 4 — 8 °С. При соблюдении всех вышеуказанных условий пересевать музейные культуры надо не реже чем через 3 мес. Производственная эффективность дрожжей, хранящихся длительное время в музее, снижается.
Приложение 8
(рекомендуемое)
ВЫЯВЛЕНИЕ И ОПРЕДЕЛЕНИЕ ОСОБЕННОСТЕЙ МОРФОЛОГИИ И ФИЗИОЛОГИИ НЕКОТОРЫХ СИСТЕМАТИЧЕСКИХ ГРУПП МИКРООРГАНИЗМОВ
Дрожжевая флора производства шампанского бутылочным и непрерывным способами разнообразна по видовому составу и принадлежит к 10 родам — Saccharomyces, Saccharomycodes, Pichia, Hanseniaspora, Brettanomyces, Candida, Kluyveromyces, Hansenula, Dekkera, Torulopsis; из них чаще встречаются первые шесть родов.
Бактерии шампанского производства изучены недостаточно.
Молочнокислые бактерии принадлежат к 3 родам — Lactobacillus, Leuconostoc, Pediococcus.
Уксуснокислые бактерии принадлежат к 2 родам — Acetobacter, Pseudomonas.
При изучении любого процесса, связанного с жизнедеятельностью микроорганизмов, необходимо знать их таксономическое положение. В производстве шампанского низшей единицей в классификации является раса или штамм дрожжей, выделенные в пределах одного вида. Штаммы объединяются в виды, виды — в роды, а роды — в семейства.
Для идентификации микроорганизмов используют возможно больше диагностических признаков: морфологических, культуральных, физиолого-биохимических и других.
Морфология микроорганизмов весьма изменчива и зависит от условий культивирования, возраста, вида и т.д., поэтому при изучении морфологии дрожжей следует пользоваться культурами одного возраста, выращенными в одинаковых условиях. Для этого образцы высевают на агаризованную винную среду с сахаром в чашку Петри и инкубируют в термостате при температуре 28 °С в течение 24 ч. Чистые культуры микроорганизмов отсеивают в бутылочки для хранения под давлением диоксида углерода при температуре 8 °С и в пробирки с жидкой средой, которые используют для идентификации. Форму, размеры клеток, способ размножения, выявление спор, капсул, запасных веществ, кислотоустойчивость, подвижность, а также окраску по Граму изучают при микроскопировании препаратов.
Под культуральными признаками подразумевают характер роста микроорганизмов на жидких и плотных средах. При росте на жидкой среде наблюдают образование пленки, пристенного кольца, осадка, на плотной среде — форму, размеры, оптические свойства, цвет, поверхность, структуру и консистенцию колоний.
К физиолого-биохимическим признакам относятся некоторые особенности обмена веществ клетки, выявляемые по способности изучаемого микроорганизма расти на принятых диагностических средах и вызывать те или иные превращения веществ, входящих в состав этих сред. Как правило, определяют следующие показатели:
• сбраживание различных углеводов (глюкозы, галактозы, сахарозы, мальтозы, лактозы, раффинозы) в трубках Дунбара на дрожжевой воде с массовой концентрацией исследуемого сахара 2 г/куб. дм;
• ассимилирующую способность различных углеводов и сахаро-спиртов (обычно используют 30 — 40 углеводных соединений), которую определяют прямым подсчетом количества клеток или нефелометрически;
• способность усваивать нитраты, т.е. превращать их в усвояемый азот, определяют на жидкой среде с добавлением нитрата калия или сернокислого аммония;
• потребность в ростовых веществах изучают на минеральной среде с последовательным добавлением избранных витаминов (биотин, пиридоксин, тиамин, пантотеновая кислота, мезоинозит, никотинамид, парамино-бензойная кислота);
• холодостойкость определяется способностью колоний микроорганизмов расти на солодовом агаре при температуре от 5 до 12 °С;
• спиртоустойчивость дрожжей определяют по сбраживаемости высокосахаристой среды с объемной долей спирта 8 — 12%;
• кислотоустойчивость микроорганизмов подтверждается ростом на среде с рН 3,5; 3,0 и 2,7;
• образование аммиака свойственно микроорганизмам, дезаминирующим аминокислоты;
• образование сероводорода свойственно микроорганизмам, использующим в процессах метаболизма содержащиеся в среде аминокислоты (цистеин, цистин, метионин и др.).
Пользуясь полученными морфологическими, культуральными, физиологическими и биохимическими признаками микроорганизмов, можно при помощи определителей установить их принадлежность к конкретному роду и виду.
Основные микроорганизмы, встречающиеся в шампанском производстве:
Saccharomyces vini Pichia dispora
Saccharomyces oviformis Dekkera bruxelensis
Saccharomyces rosei Dekkera intermedia
Saccharomyces bailii var bailii Hansenula anomala
Saccharomyces rouxii Kluyveromyces bulgaricus
Saccharomyces heterogeicus Torulopsis apicola
Saccharomyces bisporus var bisporus Lactobacillus plantarum
Saccharomycodes ludwigii Lactobacillus brevis
Brettanomyces intermedius Lactobacillus buchneri
Brettanomyces bruxelensis Lactobacillus fermentii
Candida valida Leuconostoc gracile
Candida vini Leuconostoc oinos
Candida rugosa Pediococcus cerevisia
Hanseniaspora uvarum Acetobacter xylinum
Pichia membranaefasiens Acetobacter rancens
Краткая характеристика микроорганизмов
Род Saccharomyces занимает главное место в производстве шампанского. Виды, относящиеся к этому роду, не различаются по морфологии. Клетки разнообразной формы — округлые, овальные или удлиненные. Размеры (10,5 — 18) х (3,5 — 10,5) мкм. Размножение вегетативное, многосторонним почкованием. Общей чертой является активное сбраживание глюкозы. Хорошо различаются по отношению к другим углеводам. Нитраты не усваивают.
Saccharomyces vini — культура на сусло-агаре формирует колонии круглой формы с выпуклым центром и ровными краями, желтовато-белого цвета, маслянистые, гладкие или складчато-шероховатые, морщинистые. Сбраживают и ассимилируют все сахара, ассимилируют этанол, глицерин, маннит, сорбит, фумаровую, уксусную и молочную кислоты. Обладая высокой активностью дыхания и брожения, хорошей способностью к размножению, они быстро становятся доминирующими в брожении вина, придают ему характерный букет и вкус, определяют состав. Однако в осадках старых вин этот вид дрожжей встречается редко, так как после брожения они вытесняются более спиртовыносливыми дрожжами.
Saccharomyces oviformis — штрих-культура маслянистая, иногда ломкая, кремовая или коричневато-кремовая, обычно несколько приподнятая, гладкая, иногда со своеобразными складками, бородавчатая или неровная, блестящая или довольно тусклая. Край может быть цельным или волнообразным. Сбраживают и ассимилируют все сахара, кроме галактозы; не ассимилируют сорбозу, целлюлозу, ксилозу, рамнозу, декстрин, крахмал, инулин, арабинозу, инозит, маннит, сорбит, дульцит; ассимилируют уксусную кислоту и молочную кислоту. Благодаря высокой устойчивости к спирту содержание их непрерывно растет в ходе брожения, и они его завершают.
Saccharomyces rosei слабо ферментируют и ассимилируют все сахара, кроме галактозы и мальтозы; не ассимилируют сорбозу, мальтозу, целлобиозу, декстрин, крахмал, инулин, арабинозу, ксилозу, рамнозу, инозит, сорбит, дульцит, органические кислоты.
Эти дрожжи медленно и равномерно сбраживают сахар, образуя незначительные количества летучих кислот с массовой концентрацией от 0,05 до 0,15 г/куб. дм. Они образуют мало 2,3-бутиленгликоля, но в достаточном количестве — янтарную кислоту.
Sacch. bailli var bailli — штрих-культура на сусло-агаре маслянистая, белая до сероватой, блестящая, иногда тусклая, край ровный или приподнятый. Сбраживают и ассимилируют только глюкозу, иногда сахарозу; ассимилируют этиловый спирт, глицерин, маннит, сорбит. Усваивают в отличие от других штаммов ксилозу, декстрин; не ассимилируют органические кислоты. Эти дрожжи отличаются высокой сульфитоустойчивостью и представляют опасность при стабилизации вин. Они обладают способностью сбраживать в растворах инвертного сахара фруктозу раньше глюкозы.
Saccharomyces rouxii является совершенной формой аспорогенных дрожжей Torulopsis. Культура на сусло-агаре маслянистая до ломкой, кремовая до коричнево-кремовой, гладкая или тусклая, выпуклая, бородавчатая, извитая до шероховатой. Край цельный или дольчатый.
Сбраживают и ассимилируют все сахара, кроме галактозы и раффинозы; ассимилируют целлобиозу, декстрин, арабинозу, этиловый спирт и янтарную кислоту.
Эти дрожжи разделяют с Sacch. bailli var bailli свойство в первую очередь сбраживать фруктозу, а не глюкозу.
Sacch. heterogenicus — штрих-культура маслянистая, гладкая, несколько приподнятая и блестящая. Края ровные. Не сбраживают галактозу и раффинозу; ассимилируют янтарную и молочную кислоты. Эти дрожжи имеют слабое распространение, плохо изучены. Известно, что они способны размножаться в вине с объемной долей спирта 13%.
Sacch. bisporus var bisp. — штрих-культура маслянистая, кремовая, гладкая и блестящая. Край ровный. Сбраживают только глюкозу; ассимилируют сорбозу, ксилозу, этиловый спирт, глицерин, маннит и сорбит.
Saccharomycodes ludwigii под микроскопом имеют вид круглых лимоновидных клеток. Размеры: 8 — 34 мкм в длину, до 4 — 9 мкм в диаметре. Форма и размеры этих дрожжей очень характерны, поэтому их можно уверенно идентифицировать в вине путем микроскопирования. Сбраживают и ассимилируют глюкозу, сахарозу и слабо раффинозу; ассимилируют глицерин, этиловый спирт и молочную кислоту. Из всех винных дрожжей они наиболее сульфитоустойчивые, погибают лишь при массовой концентрации в вине 850 мг/куб. дм сернистого ангидрида. Отличаются способностью образовывать сложные эфиры, в основном этилацетат, причем в анаэробных условиях количество их удваивается, появляется неприятный кислый запах, свойственный этилацетату.
Род Brettanomyces широко распространен в природе. Вегетативное размножение происходит почкованием очень медленно. На поверхности вина большинство штаммов образуют тонкую, гладкую, серовато-белую пленку. Форма клеток разнообразная, часто эллипсоидальная, яйцевидная, иногда удлиненная цилиндрическая. Размеры (4 — 10) х (2 — 4) мкм. Обладают высокой спиртообразующей способностью, но в вине с объемной долей спирта более 12% рост их прекращается. Эти дрожжи при брожении образуют эфиры (главным образом уксусно-этиловый эфир), обладающие яблочным (фруктовым) ароматом, летучие и нелетучие кислоты (уксусную и лимонную кислоты), придающие вину лекарственный тон в букете и мышиный привкус, свойственный ацетамиду. Продукты обмена этих культур ухудшают рост и бродильные свойства культурных дрожжей, являясь причиной недоброда бродильной смеси. При бутылочной шампанизации наличие мелких, образующих пылевидный осадок клеток Brettanomyces, затрудняет процесс ремюажа и дегоржажа. Эти дрожжи термофильные, с оптимальной температурой роста 32 °С, несульфитоустойчивые.
Brettanomyces intermedius — колонии на сусло-агаре, очень мелкие, круглые, белые или коричневатые, блестящие. Хорошо сбраживают и ассимилируют глюкозу, мальтозу, иногда слабо — раффинозу; ассимилируют целлобиозу, этиловый спирт, глицерин, салицин, янтарную и молочную кислоты.
Brettanomyces bruxelensis — штрих-культура маслянистая, кремовая, блестящая, гладкая до бородавчатой. Край цельный, неразделенный или дольчатый. Сбраживают и ассимилируют глюкозу, сахарозу, мальтозу; ассимилируют инулин, этанол, глицерин, сорбит, молочную и янтарную кислоты; ассимилируют нитраты.
Candida Berkhout (прежнее название Mycoderma) состоит из 81 вида довольно распространенных в виноделии дрожжей. В производстве шампанского выделены 3 вида — С. valida, С. vini и С. rugosa, относящиеся к пленчатым неспорообразующим дрожжам. Эти дрожжи размножаются на поверхности вина при доступе воздуха, образуя сухую и морщинистую пленку от белого до желтого цвета, обрывки которой выпадают в осадок. Клетки этого рода дрожжей могут быть шаровидными, овальными или сосисковидными. Форма клеток в пленке более удлиненная, большего размера с липоидными включениями. Размеры клеток (3 — 12) х (2 — 5) мкм. Размножение обычно проходит мультиполярным почкованием. Эти дрожжи образуют значительные количества летучих кислот и снижают содержание спирта в вине. Развитие дрожжей этого вида является причиной появления «цвели», пленки на поверхности вина, а также резкого изменения его вкуса; вино становится жидким, пустым.
Продукты метаболизма дрожжей Candida тормозят развитие винных дрожжей и снижают их бродильную способность при вторичном брожении в связи с малыми размерами клеток, особенно в диаметре, могут быть причиной недоброкачественной фильтрации.
Candida valida — штрих-культура сероватая, тусклая до полутусклой, мягкая, почти гладкая или слегка сморщенная. Сахара не сбраживают; ассимилируют только глюкозу, этанол и молочную кислоту, часть штаммов усваивают d-ксилозу, глицерин, лимонную кислоту, ассимилируют нитраты и хорошо растут на средах в отсутствии витаминов. Эти дрожжи отличаются высокой термостабильностью в интервале температур от 33 до 41 °С, а также продуцированием в культуральную жидкость всех кислот цикла Кребса.
Candida vini — штрих-культура сероватая до кремовой, тусклая или полутусклая, мягкая, гладкая или полностью гранулированная. Сахара не сбраживают, ассимилируют глюкозу, этанол, маннит, часть штаммов усваивает глицерин и молочную кислоту. Не используют нитраты в качестве источника азота и требуют для роста из витаминов только биотин.
Candida rugosa — штрих-культура от грязно-белого до серо-желтого цвета, со сморщенной поверхностью, но может быть иногда частично или полностью гладкой. Морщинистые штаммы тусклые с влажной поверхностью, гладкие — тускло-блестящие. Сахара не сбраживают, ассимилируют глюкозу, галактозу, l-сорбозу, d-ксилозу, l-арабинозу, этанол, глицерин, маннит, сорбит, янтарную и молочную кислоты. Все штаммы нуждаются в биотине, часть — в пиридоксине и тиамине.
Этот штамм дрожжей растет при высокой температуре, в диапазоне 37 — 43 °С. При изучении микрофлоры виноделия дрожжи C. rugosa встречаются редко и выделены в производстве шампанского из бутылок с готовой продукцией перед укупоркой. Эти дрожжи обычно обнаруживают при обследовании воды, воздуха и других природных субстратов, а в шампанское они могут быть занесены с промывной водой либо из воздуха.
Hanseniaspora uvarum (прежнее название Kloeckera Apiculata) встречаются в зонах умеренного климата на всех видах плодов, содержащих глюкозу и фруктозу. При созревании винограда эти дрожжи обнаруживаются первыми, а в период зрелости составляют 99% от всех дрожжей, выделяемых с винограда. Характеризуются быстрым размножением — в 2 раза быстрее винных дрожжей, некоторые штаммы могут сбраживать сусло до объемной доли спирта 6 — 7%. Продукты их метаболизма угнетают развитие культурных дрожжей, являясь причиной недображивания вина и повышенных концентраций летучих кислот и эфиров, придающих винам несвойственный им аромат яблочного вина. Клетки имеют характерную лимонообразную форму. Размеры (5 — 8) х (2 — 4) мкм. На сусло-агаре образуют серо-кремовые гладкие блестящие колонии. Споры не образуют.
Дрожжи H. uvarum имеют клетки характерной лимонообразной формы размером (4 — 10) х (2 — 4) мкм, т.е. достаточно мелкие; размножаются биполярным почкованием, образуют споры в виде шляпы, 2 — 4 в аске, или шаровидной формы, 1 — 2 в аске.
Сбраживают и ассимилируют глюкозу и фруктозу; ассимилируют целлобиозу. Нуждаются в витаминах, главным образом в мезоинозите, биотине и пантотеновой кислоте.
Дрожжи Н. uvarum отличаются высокой выживаемостью в винах с объемной долей спирта 10 — 11% или в шампанском, выдержанном до 15 лет, низкой сульфитоустойчивостью, 70 — 100 мг/куб. дм. При температуре 35 °С эти дрожжи прекращают размножаться, а при температуре 45 °С погибают.
При бутылочном способе шампанизации эти дрожжи из-за малых размеров клеток долго не оседают и являются причиной образования липнущих осадков, затрудняющих дегоржаж.
Род Pichia Hansen. Из 35 видов этого рода в виноделии обнаружены только 3 вида, из них 2 вида выделены в производстве шампанского: P. membranaefaciens, P. dispora, относящиеся к пленчатым, спорообразующим дрожжам. Характерной особенностью их является быстрое развитие на поверхности вина, с образованием толстой бело-желтой морщинистой пленки, в основном за счет окисления спиртов и органических кислот. Кроме того, дрожжи Pichia активно разлагают глицерин, превращая его в молочную кислоту. Нитраты не ассимилируют. Форма клеток овальная, удлиненная, реже круглая, размеры (4 — 10) х (2 — 5) мкм. При развитии этих дрожжей в вине значительно изменяются его вкусовые качества и состав — увеличивается содержание летучих кислот, слабеет окраска, во вкусе появляются фруктово-эфирные и аптечные тона, снижается бродильная способность винных дрожжей.
Pichia membranaefaciens на сусло-агаре образуют желтые блестящие колонии, гладкие, иногда сморщенные. Сахара не сбраживают, ассимилируют путем окисления глюкозу, этанол, янтарную и молочную кислоты, глицерин и ксилозу. Не нуждаются в витаминах.
Pichia dispora — штрих-культура кремовая до коричневатой, мягкая, гладкая, ровная и блестящая. Сбраживают только глюкозу; ассимилируют глюкозу, трегалозу, этанол, маннит, сорбит, молочную и янтарную кислоту. Не растут на витаминосвободной среде.
Род Dekkera van der Walt. В шампанском производстве выделены два вида: Dekkera intermedia и Dekkera bruxelensis.
Dekkera intermedia — штрих-культура на солодовом агаре, маслянистая, обычно исчерченная, кремовая, блестящая или несколько тусклая, гладкая или бородавчатая. Край цельный неразделенный или дольчатый. Является совершенной формой аспорогенных дрожжей Brettanomyces intermedia. Форма клеток сфероидальная, обычно эллипсоидальная, часто яйцевидная, размер клеток (4 — 18) х (2 — 7) мкм. Образуют тонкую тусклую пленку. Продуцируют характерный аромат. Споры шляповидные, 1 — 4 в аске. Сбраживают глюкозу, галактозу, сахарозу, мальтозу, ассимилируют глюкозу, галактозу, сахарозу, мальтозу, целлобиозу, раффинозу, этанол, глицерин, сорбит, молочную и янтарную кислоты. Усваивают нитраты, но не растут на витаминосвободной среде.
Род Hansenula Sydow. Известно 25 видов рода, 2 вида обнаружены в винах. В производстве шампанского дрожжи Hansenula anomala выделены только из необработанных виноматериалов. Форма клеток овальная, удлиненная. Размер (2 — 12) х (2 — 5) мкм. Хорошо выражена спорообразующая способность. На плотной среде культура имеет белую, ровную, матовую окраску, со временем образует складки. Сбраживают и ассимилируют глюкозу, мальтозу, сахарозу, галактозу и раффинозу на 1/3; ассимилируют этанол, глицерин, маннит, сорбит, молочную кислоту. Используют нитраты. Эти дрожжи образуют большие количества этилацетата как в аэробных, так и в анаэробных условиях, придающих вину резкий, не свойственный ему аромат. Эффективная борьба с ними требует точного соблюдения производственного режима при строгом соблюдении общих санитарно-гигиенических мероприятий на производстве.
Род Kluyveromyces van der Walt. Описано 18 видов этого рода, 2 вида найдены в бродящем сусле. В производстве шампанского дрожжи Kluyveromyces bulgaricus выделены только из ассамбляжа. Размножаются они почкованием. Форма клеток различная: сфероидальная, полушаровидная, эллипсоидальная или цилиндрическая; размер (4 — 10) х (3 — 6) мкм. Эти дрожжи отличаются от Saccharomyces формой спор, их тенденцией к агглютинации после разрыва асков, а также потребностью в витаминах для роста. Культура на сусло-агаре маслянистая, кремовая, ровная, гладкая и блестящая. Край может быть цельным, неразделенным или дольчатым. Сбраживают и ассимилируют глюкозу, галактозу, сахарозу, лактозу, раффинозу, ассимилируют инулин, ксилозу, этанол, глицерин, маннит, сорбит, молочную и янтарную кислоты. Не ассимилируют нитраты. Установлено, что присутствие дрожжей К. bulgaricus в бродящем сусле совместно с винными дрожжами замедляет процесс брожения.
Род Torulopsils Berlex. Описано 36 видов этого рода, из них 6 найдены в сусле, винах и на оборудовании. В производстве шампанского 2 вида дрожжей этого рода выделены из необработанных виноматериалов. Размножаются они мультиполярным почкованием. Форма клетки сферическая или овальная, размеры (3 — 6) х (2 — 5) мкм. Среди них обнаружены окрашенные дрожжи: желтые, розовые, красные. Могут образовывать на поверхности вина кольцо или пленку. Отличаются от винных дрожжей тем, что не образуют споры, имеют слабую способность к сбраживанию и могут накапливать в клетках большое количество липидов в виде блестящих капелек, заполняющих всю клетку. Нитраты не ассимилируют.
Torulopsis apicola — на сусло-агаре культура желтоватая и кремовая, стекловидная, блестящая, мягкая и гладкая. Сбраживают и ассимилируют глюкозу, сахарозу, раффинозу; ассимилируют сорбозу, глицерин, маннит, сорбит; растут на витаминосвободной среде, оптимальная температура роста — в пределах 32 — 37 °С.
Эти дрожжи отличаются от большинства других тем, что сбраживают фруктозу в 10 раз быстрее, чем глюкозу; кроме того они обладают осмофильными свойствами и могут развиваться в среде с массовой концентрацией сахара 600 г/куб. дм и повышенной температурой, будучи чувствительными к холоду. Сульфитоустойчивость этих дрожжей одинакова с винными дрожжами. Дрожжи Т. apicola могут развиваться в среде с объемной долей спирта 12,5%, обладают способностью к образованию уксусной кислоты, являются слабыми эфирообразователями, винам не придают особых органолептических свойств, однако некоторые штаммы образуют в сусле и в вине слизь. Дрожжи этого вида в основном выделяют из винограда, пораженного благородной гнилью.
Torulopsis inconspicua — на сусле-агаре культура серовато-белая, полутусклая, мягкая, гладкая или полосатая.
Сбраживание сахаров отсутствует. Ассимилируют глюкозу, этанол, глицерин, молочную и янтарную кислоты. Рост на витаминосвободной среде отрицательный и стимулируется пиридоксином, тиамином и биотипом. Максимум роста при температуре 39 — 42 °С.
Плесневые грибы относятся к классу низших споровых растений, очень разнообразны и широко распространены в природе. В производстве шампанского являются вредителями, в вине обычно не размножаются, но сохраняются в виде спор. Плесени могут развиваться на поверхности длительно хранящегося в аэробных условиях некондиционного вина, а также попадать в вино из оборудования, воздуха и в готовую продукцию после недоброкачественной мойки бутылок. Вино, соприкасающееся с оборудованием, покрытым плесенью или укупоренное заплесневевшими пробками, приобретает плесневый тон и считается непригодным к употреблению. Поэтому необходимо своевременно принимать меры, предупреждающие появление плесени. В вине обнаружены следующие роды плесени: Mucor, Aspergillus, Penicillium, Monilia и др.
Уксусные бактерии (Acetobacter), развивающиеся в винах, представлены несколькими видами. Они представляют собой неспорогенные подвижные короткие палочки (диаметр 0,5 — 1,0 мкм), расположенные одиночно, цепочками, но чаще всего в виде диплобактерий, грамотрицательны. Развиваются очень быстро при доступе воздуха на поверхности вин, содержащих объемную долю спирта до 12,8%, образуя пленку. Особенно интенсивно молодые, размножающиеся клетки окисляют спирт до уксусной кислоты, а в отдельных случаях до углекислого газа и воды. Развитию уксуснокислых бактерий способствует недолив резервуаров, негерметичность укупорки и высокая температура в винохранилище.
Молочнокислые бактерии широко распространены в природе во многих местах обитания, а различные условия существования определяют их специфику приспособления. Поэтому молочнокислые бактерии могут изменять способность положительной окраски по Граму, расти в определенных средах, изменять морфологические и культуральные свойства, температурные границы роста и т.д. в зависимости от возраста культуры и условий культивирования.
Форма бактерий является достаточно стабильной характеристикой. Различают кокки (диаметр 0,4 — 1,0 мкм), длинные и короткие палочки, но всех их объединяет ряд общих свойств. Все они бесспоровые, неподвижные, грамположительные, факультативно-анаэробные, всегда нуждаются в углеводах, каталазонегативные, не восстанавливают нитраты в нитриты.
Молочнокислые бактерии, встречающиеся в вине, принадлежат к родам Leuconostoc, Pediococcus, Lactobacillus.
По характеру брожения молочнокислые бактерии разделяют на гомоферментативные, образующие из сахара только молочную кислоту, и гетероферментативные, образующие кроме молочной кислоты, еще этиловый спирт, уксусную кислоту, глицерин и углекислый газ. Молочнокислые бактерии могут проводить в вине яблочно-молочное брожение, разлагая яблочную кислоту на молочную кислоту и углекислый газ, что приводит к снижению концентрации титруемых кислот в вине и увеличению значения рН. Возбудителями яблочно-молочного брожения могут быть гомоферментативные палочки и гетероферментативные кокки рода Leuconostoc, при условии наличия в среде яблочной кислоты в качестве единственного источника углерода. Яблочно-молочное брожение является единственным полезным процессом, проводимым молочнокислыми бактериями. Однако при отсутствии яблочной кислоты и наличии остаточного сахара бактерии могут вызывать нежелательное гетероферментативное молочнокислое брожение, и вино приобретает неприятный кисло-сладкий вкус. Контроль вин, в которых проходит яблочно-молочное брожение, осуществляют микроскопированием вина, определением концентрации титруемых кислот, винной, яблочной и молочной кислот.
Для предотвращения развития молочнокислых бактерий необходимо учитывать влияние активной кислотности среды, температуры, аэрации, азотистого питания, ингибирующего действия спирта, сернистого ангидрида и др.
© интернет
СБОРНИК ОСНОВНЫХ ПРАВИЛ, ТЕХНОЛОГИЧЕСКИХ ИНСТРУКЦИЙ И НОРМАТИВНЫХ МАТЕРИАЛОВ ПО ПРОИЗВОДСТВУ ВИНОДЕЛЬЧЕСКОЙ ПРОДУКЦИИ
■■ Важно! Будьте в курсе о новых рецептов — подпишитесь. Это просто и быстро.
Немного рекламы, которая возможно поможет развитию сайта…

 20 января, 2018
20 января, 2018  malcovsky
malcovsky  Опубликовано в рубрике
Опубликовано в рубрике  Метки:
Метки: